علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Spectroscopic Properties of Alkenes
المؤلف:
John D. Roberts and Marjorie C. Caserio
المصدر:
Basic Principles of Organic Chemistry : LibreTexts project
الجزء والصفحة:
........
16-1-2022
2932
Spectroscopic Properties of Alkenes
The infrared spectra of alkenes are sufficiently different from those of alkanes in most instances to make it possible to recognize when a double bond is present. For example, in the infrared spectrum of 1-butene (Figure 10-1) the absorption band near 1650 cm−1 is characteristic of the stretching vibration of the double bond. In general, the intensity and position of this band depends on the structure of the alkene; it varies with the degree of branching at the double bond, with the presence of a second unsaturated group in conjugation with the first (i.e., 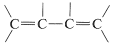 or
or 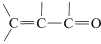 ), and with the symmetry of the substitution of the double bond . However, in many cases the absorption bands caused by the various modes of vibration of the alkenic C−HC−H bonds frequently are more useful for detecting a double bond and identifying its type than is the absorption band caused by C=C stretch. With 1-butene, absorptions arising from the C−H vibrations of the terminal =CH2 group occur near 3100 cm−1, 1420 cm−1, and 915c m−1, and those of the −CH= grouping near 3020cm−1, 1420 cm−1, and 1000cm−1. In general, absorption bands at these frequencies are from the grouping −CH=CH2. The bands near 1420 cm−1 are due to in-plane bending, whereas those at 915 cm−1 to 1000 cm−1 arise from out-of-plane bending. The other intense absorptions, near 1460 cm−1 and 3000 cm−1, are due to C−H vibrations of the CH3CH2− group . These illustrate a further point - namely, the positions of the infrared absorptions of alkyl C−H bonds are significantly different from those of alkenic C−H bonds.
), and with the symmetry of the substitution of the double bond . However, in many cases the absorption bands caused by the various modes of vibration of the alkenic C−HC−H bonds frequently are more useful for detecting a double bond and identifying its type than is the absorption band caused by C=C stretch. With 1-butene, absorptions arising from the C−H vibrations of the terminal =CH2 group occur near 3100 cm−1, 1420 cm−1, and 915c m−1, and those of the −CH= grouping near 3020cm−1, 1420 cm−1, and 1000cm−1. In general, absorption bands at these frequencies are from the grouping −CH=CH2. The bands near 1420 cm−1 are due to in-plane bending, whereas those at 915 cm−1 to 1000 cm−1 arise from out-of-plane bending. The other intense absorptions, near 1460 cm−1 and 3000 cm−1, are due to C−H vibrations of the CH3CH2− group . These illustrate a further point - namely, the positions of the infrared absorptions of alkyl C−H bonds are significantly different from those of alkenic C−H bonds.
Figure 10-1: Infrared spectrum of 1-butene showing the vibrational assignments made to the various absorptions.
The double bonds of an alkene with no alkenic hydrogens are difficult to detect by infrared spectroscopy and in such cases Raman spectroscopy is helpful.
The infrared absorption of 1-butene that occurs at 1830 cm−1 falls in the region where stretching vibrations of alkene bonds usually are not observed. However, this band actually arises from an overtone (harmonic) of the =CH2 out-of-plane bending at 915cm−1. Such overtone absorptions come at exactly twice the frequency of the fundamental frequency, and whenever an absorption like this is observed that does not seem to fit with the normal fundamental vibrations, the possibility of its being an overtone should be checked.
With regard to electronic spectra, a π electron of a simple alkene can be excited to a higher energy (π∗) state by light of wavelength 180nm180nm to 100nm. However, many other substances absorb in this region of the spectrum, including air, the quartz sample cell, and most solvents that might be used to dissolve the sample, and as a result the spectra of simple alkenes are not obtained easily with the usual ultraviolet spectrometers. When the double bond is conjugated as in 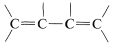 or
or 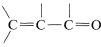 , then the wavelengths of maximum absorption shift to longer wavelengths and such absorptions are determined more easily and accurately.
, then the wavelengths of maximum absorption shift to longer wavelengths and such absorptions are determined more easily and accurately.
In proton nmr spectra, the chemical shifts of alkenic hydrogens are toward lower fields than those of alkane hydrogens and normally fall in the range of 4.6-5.3 ppm relative to TMS .
 الاكثر قراءة في التشخيص العضوي
الاكثر قراءة في التشخيص العضوي
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)