علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Butadiene and π-electron binding energy
المؤلف:
Peter Atkins، Julio de Paula
المصدر:
ATKINS PHYSICAL CHEMISTRY
الجزء والصفحة:
ص390-391
2025-11-29
470
Butadiene and π-electron binding energy
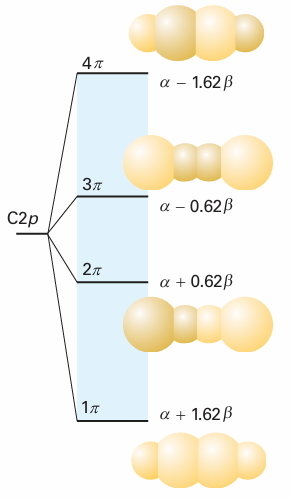
As we saw in the preceding example, the energies of the four LCAO-MOs for butadiene are , E=α±1.62β, α±0.62β , These orbitals and their energies are drawn in Fig. 11.39. Note that the greater the number of internuclear nodes, the higher the energy of the orbital. There are four electrons to accommodate, so the ground-state configuration is 1π2 2π2. The frontier orbitals of butadiene are the 2π orbital (the HOMO, which is largely bonding) and the 3πorbital (the LUMO, which is largely antibonding). ‘Largely’ bonding means that an orbital has both bonding and antibonding interactions between various neighbours, but the bonding effects dominate. ‘Largely antibonding’ indicates that the antibonding effects dominate.
An important point emerges when we calculate the total π-electron binding energy, Eπ, the sum of the energies of each π electron, and compare it with what we find in ethene. In ethene the total energy is
Eπ =2(α+β)=2α+2β
In butadiene it is
Eπ =2(α+1.62β) +2(α+0.62β) =4α+4.48β
Therefore, the energy of the butadiene molecule lies lower by 0.48β (about 110 kJ mol−1) than the sum of two individual π bonds. This extra stabilization of a con jugated system is called the delocalization energy. A closely related quantity is the π-bond formation energy, the energy released when a π bond is formed. Because the contribution of α is the same in the molecule as in the atoms, we can find the π-bond formation energy from the π-electron binding energy by writing
Ebf = Eπ −Nα
where N is the number of carbon atoms in the molecule. The π-bond formation energy in butadiene, for instance, is 4.48β

Fig. 11.39 The Hückel molecular orbital energy levels of butadiene and the top view of the corresponding π orbitals. The four p electrons (one supplied by each C) occupy the two lower π orbitals. Note that the orbitals are delocalized.


 الاكثر قراءة في اختراعات ومكتشفون
الاكثر قراءة في اختراعات ومكتشفون
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)