


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2025-03-19
التاريخ: 31-5-2021
التاريخ: 2025-04-03
التاريخ: 2025-03-13
|
1- يؤدي الإنزيم وظيفته بصورة كاملة تحت الظروف الفسيولوجية المثلى من درجــة الحــرارة والأس الهيدروجيني pH وخصوصية المادة الأساس.
2- جميع الإنزيمات مواد بروتينية (باستثناء مجاميع صغيرة من RNA التي اكتشفت حديثاً بأن لديها فعالية إنزيمية).
3- لا تظهر العديد من الإنزيمات فعاليتها في حالة عدم وجود احد المكونات غير البروتينية والذي يطلق عليه بالعامل المرافق (Cofactor) . ويطلق على الجزء البروتيني غيـر الفعـــال بـــــــ apoenzyme وبالمقابل يطلق على الإنزيم الفعال (الجزء البروتيني والعامل المرافق) بـــــــ Holoenzyme. وتكون العوامل المساعدة إما على شكل معادن مثل أيونات المغنيسيوم والمنغنيز والحديد والسلينيوم والنحاس، أو على شكل جزيئة عضوية تسمى مرافقات الإنزيم Coenzymes مثل NADH و NADPH و FAD وغيرها، وتحتاج بعض الإنزيمات إلى كلا النوعين أي الأيونات المعدنية ومساعدات الإنزيم. وعند ارتباط العوامل المرافقة بأصرة تساهمية مع الإنزيم فيطلق عليها بالمجموعة الرابطة (المجموعة الترقيعية) Prosthetic group.
4- إن الفرق بين التفاعلات الإنزيمية والتفاعلات غير الإنزيمية هو أن مادة الأساس في التفاعلات الإنزيمية تتحول بكفاءة وسرعة عاليتين، في حين أن التفاعلات غير الإنزيمية هناك نسبة معينة من المادة الأولية تتحول إلى ناتج والباقي من المادة الأولية تفقد في كثير من التفاعلات الجانبية، فعلى سبيل المثال إنزيم الكاتاليز Catalase الذي يحفز التفاعل الآتي:
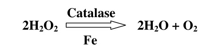
إن التفاعل السابق يتم ببطؤ شديد بغياب الإنزيم، ولكن كفاءة التحول إلى ناتج وسرعة التفاعل بوجود إنزيم الكاتاليز تكون عالية تحت الظروف المثلى من درجة حرارة والأس الهيدروجيني وتركيز بيروكسيد الهيدروجين H2O2)) .
5- إن من أهم خواص الإنزيمات هي كونها متخصصة إذ تعمل على مادة أساس واحدة أو عدة مواد أساسية (ولكنها من نفس النوع لينتج عن ذلك ناتج أو عدة نواتج.
6- الأواصر التي تثبت سلسلة جزيئة الإنزيم في أوضاعها استناداً الى ما ذكرت سابقاً للبروتينات وهي: الأواصر الأيونية، الأواصر الهيدروجينية، الأواصر الهيدروفوبية، الأواصر ثنائية الكبريت ، تجاذب قــوى فاندرفال، التداخلات القطبية للمجاميعinteractions groupsPolar
7- تحتوي جميع الإنزيمات على منطقة تسمى الموقع الفعال Active site وهي وحدات من الأحماض الأمينية في الإنزيم تشترك في عملية التحفيز Catalysis وتكون على شكل حفرة أو التفاف لسلسلة متعددة الببتيد يربط الجزيئات المتفاعلة بحيث تكون هذه الجزيئات مثبتة بوضع فراغي صحيح في الموقع الفعال، ملائماً تماماً للتفاعل وإن الطبيعة الكيميائية لوحدات الأحماض الأمينية في الموقع الفعال تلعب أيضاً دوراً فعالاً وذلك بمنحها أو سحبها للالكترونات من المجاميع الوظيفية للمادة الأساس. أن القـوى التي تربط المادة الأساس بالموقع الفعال تكون ضعيفة نسبياً وبهذا فان تحرر النواتج مـــن علـــى سـطح الإنزيم بعد اكتمال التفاعل يكون سهلاً. وإن لكل إنزيم عدداً محدداً من المواقع الفعالة فإنزيم التربـــين مثلاً يحتوي على مركز فعال واحد بينما إنزيم اليوريز يحتوي على أربعة مراكز فعالة.
8- الإنزيمات لها أوزان جزيئية بين 13000 دالتون الإنزيم الرايبونيوكليز إلى عدة ملايين لبعضها الآخر وهذه المقادير تدل على كبر حجم جزيئات الإنزيم ولذا تكون محاليل غروية عند إذابتها بالماء.
9- قد توجد إنزيمات في كائنات حية ولا توجد في كائنات حية أخرى مثل إنزيم السليوليز Cellulase الذي يعمل على تحليل جزيئة السليلوز إلى جزيئات سكر قابلة للهضم والامتصاص في الأبقار وغيرها وعـــــدم وجودها في الإنسان، وقد تقوم البكتريا بإفراز إنزيم السليوليز في أحشاء النمل الأبيض وهذا يفسر كيـف تأكل النمل العشب والخشب.


|
|
|
|
حقن الذهب في العين.. تقنية جديدة للحفاظ على البصر ؟!
|
|
|
|
|
|
|
"عراب الذكاء الاصطناعي" يثير القلق برؤيته حول سيطرة التكنولوجيا على البشرية ؟
|
|
|
|
|
|
|
جمعية العميد تعقد اجتماعها الأسبوعي لمناقشة مشاريعها البحثية والعلمية المستقبلية
|
|
|